
【 청년일보 】 대한민국 제약·바이오업계를 이끌어나갈 것으로 기대를 모았던 국내 기업이 지난해부터 각종 악재가 터지며 ‘하향세'를 내딛고 있다.
이들의 추락이 더욱 충격적인 이유는 성공률이 약 10%에 불과한 ‘신약 개발 과정’을 통과한 뒤 뒤늦게 과정에서의 오류가 드러나고 있기 때문이다.
이제 막 시장에 제품을 내놓고 ‘꽃길’을 걷기 시작했거나 이미 수년 간 시장을 이끌었던 기업들이 한순간에 무너지는 사례들이어서 더욱 충격적이며 치명적이란 평가가 나온다.
◇ 15년 만에 드러난 진실…무너진 ‘글로벌 블록버스터’의 기대
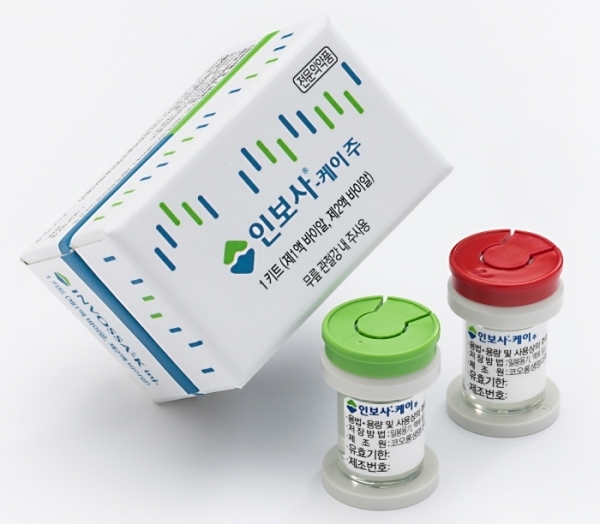
가장 먼저 롤러코스터에 탑승한 기업은 세계 최초 골관절염 세포 유전자 치료제 ‘인보사’를 개발·출시하며 인보사를 글로벌 블록버스터 의약품으로 키우겠다는 야심 찬 계획을 밝혔던 코오롱생명과학이다.
인보사는 사람 연골에서 추출한 ‘연골세포’(HC)가 담긴 1액과 연골세포 성장인자(TGF-β1)를 도입한 ‘형질전환세포’(TC)가 담긴 2액을 3 대 1 비율로 섞어 무릎 관절강 내에 주사하는 세포 유전자 치료제다.
국내 출시 9개월 만에 투약 환자가 1,500명을 돌파하는 등 블록버스터급 신약으로 성장했으며, 글로벌 시장에서의 연간 매출이 최대 100억 달러(한화 약 12조원)로 추산될 만큼 출시 이후 ‘탄탄대로’를 걸었다.
그러나 지난해 4월, 허가 당시 식약처에 제출한 자료에 적힌 성분과 실제 의약품의 세포가 다르다는 사실이 뒤늦게 드러나며 논란이 되고 있다.
미국 임상 3상 과정에서 2액 세포가 애초 식약처 허가를 받기 위해 코오롱생명과학이 제출한 자료에 기재된 ‘연골세포’가 아닌 ‘신장세포’(GP2-293세포) 였다는 것이 무려 15년 만에 밝혀지면서 충격을 주고 있다.
게다가 허가 전 2액 세포에 삽입된 연골세포 성장인자 유전자의 개수와 위치가 변동된 사실을 알고도 이를 숨긴 채 관련 자료를 식약처에 제출하지 않은 사실도 드러났다. 결국 식약처는 지난해 5월 품목허가가 취소하기에 이르렀다.
미국 식품의약국(FDA)은 지난 4월 인보사의 임상 3상 시험 보류를 해제하고 환자 투약을 재개하도록 했지만, 인보사의 재기 여부는 아직 불투명하다는게 대체적인 시각이다.

◇ 최대 위기 직면한 국산 보톡스 신화 ‘메디톡신’
지난 2006년 국산 1호 보툴리눔 톡신 ‘메디톡신’을 개발하며 ‘국산 보톡스 신화’를 이뤄냈던 메디톡스는 최근 식약처로부터 메디톡신에 대한 품목허가 취소 처분을 받으며 창사 이래 최대 위기를 맞고 있다.
검찰 등에 따르면, 메디톡스는 지난 2012년 12월부터 2015년 6월까지 무허가 원액으로 보톡스 제품을 생산하고 제품 원액 정보 및 역가(효능 강도) 시험 결과를 조작해 총 73회에 걸쳐 39만 4274병 규모의 국가 출하 승인을 받은 혐의를 받고 있다.
업계는 오는 14일까지 품목허가 취소처분 효력이 일시 정지된 메디톡신의 허가 취소가 최종적으로 결정될 경우 메디톡스는 경영상 적잖은 치명상을 입게 될 것으로 전망하고 있다.
메디톡스가 지난 2006년 국내 1호이자 전 세계 네 번째로 개발에 성공한 메디톡신은 명실공히 국내 보툴리눔 톡신 시장 점유율 1위를 지켜온 제품이기 때문이다.
지난해 메디톡스 전체 매출(2,059억원)의 42.1%(868억원)를 차지한 핵심 주력 제품 메디톡신의 시장 내 판매가 중단될 경우 메디톡스의 매출 하락은 불가피하다는 게 업계의 평가다.
업계 관계자는 “코오롱생명과학과 메디톡스 모두 신약 개발 과정을 무사히 통과해 시장에 제품을 내놓은 뒤 뒤늦게 품목허가 취소 처분을 받게 됐다”며 “결과에 대한 조급증이 과정에서의 오류를 불러온 것은 아닌지 한 번쯤 되돌아볼 필요가 있다”고 조언했다.
【 청년일보=안상준 기자 】


