【 청년일보 】 셀트리온헬스케어에서 직접 판매(직판) 중인 자가면역질환 치료용 피하주사제형 바이오 의약품 ‘램시마SC’(인플릭시맙)가 프랑스에서 첫 처방이 이뤄지며 본격적인 유럽 판매 확대에 돌입했다. 셀트리온헬스케어는 이달 초 프랑스에 ‘램시마SC’를 출시한 이후 마케팅 활동의 일환으로 현지 언론사를 초청해 ‘램시마SC 런칭 온라인 기자간담회’를 개최했다고 17일 밝혔다. 이날 행사에는 프랑스 낭시 종합병원 소속으로 유럽염증성장질환학회(European Crohn’s & Colitis Organization, ECCO) 회장을 맡고 있는 로랑 페이린-비룰레(Laurent Peyrin-Biroulet) 교수, 몽펠리에 종합병원 류마티스 전문의 베르나르 콤베(Bernard Combe) 교수, 셀트리온헬스케어 프랑스법인 소속 살림 벤킬리파(Salim Benkhalifa) 의사가 참석해 ‘램시마SC’ 임상 데이터 소개 및 프랑스 런칭 의미 등에 대해 발표했다. 이날 발표에서 로랑 페이린-비룰레 교수는 “‘램시마SC’ 출시로 의료진과 환자들을 위한 인플릭시맙 피하주사제형의 꿈이 이뤄졌다”며 “이들에게 세계 최초 인플릭시맙 피하주사제형 ‘램시마SC’를 제공할 수

【 청년일보 】 셀트리온제약은 자가면역질환 치료 바이오시밀러 ‘램시마SC’(인플릭시맙)을 국내에 출시하고 본격 판매에 돌입한다고 8일 밝혔다. 회사 측은 국내 출시를 알리는 심포지엄도 개최한다. 류마티스 관절염(RA)과 염증성 장질환(IBD) 등 적응증별 주제를 나눠 심포지엄을 순차적으로 진행할 계획이다. 이달 6일, 1차로 RA 적응증 심포지엄이 온라인으로 개최됐으며, IBD 적응증 심포지엄은 이달 26일 예정돼 있다. 램시마SC는 자가면역질환 치료제(TNF-α 억제제) 시장에서 경쟁력을 확보하기 위해 기존 정맥주사 제형인 램시마를 피하주사 제형으로 변경해 개발한 세계 최초의 인플릭시맙 치료제다. 정맥 속에 바늘을 찔러 약물을 주입하는 정맥주사와 달리 피하주사는 피부 아래 조직에 약물을 소량 투여해 투약 시간이 짧다. 환자가 병원을 방문하지 않고 원하는 장소에서 직접 투여할 수 있다는 장점도 있으며 류마티스 관절염(RA), 염증성 장질환(IBD) 및 강직성 척추염(AS) 환자 치료 등에 사용된다. 셀트리온은 램시마SC의 국내 출시를 위해 지난해 2월 RA 치료제로 적응증 승인을 받았으며 8월 IBD, AS 적응증을 추가로 확보했다. 국내에 출시된 램시마SC

【 청년일보 】 셀트리온은 세계 최초 인플릭시맙(Infliximab) 피하주사 제형 자가면역질환 치료제 ‘램시마SC’가 지난달 28일(현지시간 기준) 캐나다 보건부(Health Canada)로부터 판매 승인을 획득했다고 1일 밝혔다. 램시마SC는 램시마를 기존 정맥주사(IV)에서 피하주사(SC)로 제형을 변경해 자체 개발한 바이오 의약품으로, 환자가 병원을 방문하지 않고 원하는 장소에서 직접 주사할 수 있어 치료 편의성을 크게 개선했다. 이번 램시마SC 캐나다 승인은 류마티스 관절염(RA) 적응증에 대해 이뤄졌으며, 추후 염증성 장질환(IBD) 적응증에 대한 허가를 신청할 계획이다. 캐나다 자가면역질환 치료제(TNF-α 억제제) 시장은 2019년 기준 약 2조원 정도로 집계되고 있으며, 캐나다에서만 16세 이상 성인 37만4,000명이 류마티스 관절염으로 고통받고 있는 것으로 알려졌다. 캐나다 토론토 소재 마운트 시나이(Mount Sinai) 병원 에드워드 키스톤(Edward Keystone) 교수는 “램시마SC는 기존 정맥주사(IV) 제형과 효능 및 안전성이 유사해 인플릭시맙 사용에 대한 치료 옵션을 향상시킬 수 있다”며 “램시마SC 승인은 환자들에게 집에
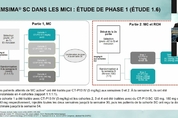
【 청년일보 】 셀트리온은 유럽연합 집행위원회(EC, European Commission)로부터 ‘램시마SC’에 대한 추가 적응증 승인을 획득했다고 27일 밝혔다. 이번 승인은 지난 6월 25일 유럽의약품청(EMA) 산하 ‘약물사용자문위원회’(CHMP, Committee for Medicinal Products for Human Use)로부터 램시마SC 적응증 추가 신청에 대해 ‘허가 승인 권고’를 받은 지 약 1개월 만에 나온 것으로 ‘코로나19’ 상황에서 이례적인 승인 절차가 이뤄졌다는 평가다. 이례적인 속도로 이뤄진 이번 추가 적응증 획득에는 유럽 현지 염증성 장질환(Inflammatory Bowel Disease, IBD) 의료진의 강력한 권고가 있었던 것으로 알려졌다. 그 동안 현지에서 인플릭시맙(Infliximab) 정맥주사(IV) 제형을 IBD 환자에게 처방해 온 의료진은 인플릭시맙 피하주사(SC) 제형이 코로나19 상황에서의 의료 편의성 증대에 도움을 줄 것이라는 탄원서를 허가기관에 제출하는 등 램시마SC의 조속한 승인을 기다려 왔다. 셀트리온은 그 동안 램시마SC의 신속한 허가를 위해 지난해 11월 류마티스 관절염(Rheumatoid Arth
【 청년일보 】 셀트리온은 최근 유럽의약품청(EMA) 산하 ‘약물사용자문위원회’(CHMP, Committee for Medicinal Products for Human Use)로부터 세계 최초 인플릭시맙(Infliximab) 피하주사(SC) 제제 ‘램시마SC’의 적응증 추가 신청에 대한 ‘허가 승인 권고’ 의견을 받았다고 29일 밝혔다. ‘램시마SC’ 적응증 추가 허가 승인 권고 의견을 낸 CHMP는 의약품에 대한 과학적 평가 결과를 바탕으로 EMA에 허가 여부 의견을 제시하는 기구로, CHMP의 허가 권고는 사실상 유럽 의약품 승인을 의미하는 것으로 해석된다. 일반적으로 유럽연합 집행위원회(EC, European Commission)의 최종 승인이 CHMP ‘허가 승인 권고’ 후 1~3개월 내 이뤄지는 것을 감안할 때 ‘램시마SC’는 조만간 기존 인플릭시맙 정맥주사(IV) 제형의 모든 성인 적응증을 획득한 최초의 인플릭시맙 SC 제형이 될 전망이다. 셀트리온은 ‘램시마SC’의 신속한 허가를 위해 지난해 11월 류마티스 관절염(Rheumatoid Arthritis, RA)을 적응증으로 우선 EMA 허가를 받고, 이후 또 다른 주요 적응증인 염증성 장질환(In