
【 청년일보 】 28일 제약업계 주요 이슈는 삼성제약이 췌장암 치료제 ‘리아백스주’의 3상 임상시험 결과보고서를 수령했다는 소식이다. 제뉴원사이언스는 한국콜마 제약사업부와 콜마파마 인수를 완료하고 통합 법인을 공식 출범했으며, 휴온스랩의 단장증후군 치료를 위한 ‘지속형 이중작용 펩타이드 의약품 개발 과제’는 중소벤처기업부가 지원하고 중소기업기술정보진흥원이 추진하는 ‘창업성장기술개발사업’에 최종 선정됐다. 디앤디파마텍은 미국 식품의약국(FDA)으로부터 비만 및 비알콜성 지방간염 치료 후보 물질 ‘DD01’의 임상 1/2a상 시험 계획(IND)을 승인 받았고, 삼양바이오팜은 골수형성이상증후군 치료제 ‘아자시티딘주’ 100mg, 150mg 두 용량의 판매 허가를 독일 의약품 허가당국으로부터 획득했다. 에이비엘바이오와 지놈앤컴퍼니는 다음달 11일부터 나흘간 개최되는 ‘제39회 JP모건 헬스케어 컨퍼런스’에 공식 초청받아 참가하며, 보령제약은 글로벌 수준의 안전 및 보건 관리체계를 인정받아 안전보건경영시스템 ‘ISO 45001’ 인증을 획득했다. 아이텍에이치앤디는 동우텍과 콜드체인기술 관련 포괄적 상호업무협약을 체결했고, 미국과 유럽연합(EU) 등에서 코로나19 백신

【 청년일보 】 디앤디파마텍은 미국 식품의약국(FDA)으로부터 비만 및 비알콜성 지방간염 치료 후보 물질 ‘DD01’의 임상 1/2a상 시험 계획(IND)을 승인 받았다고 28일 밝혔다. ‘DD01’은 체중 감소 효과를 극대화하기 위해 글루카곤(Glucagon, GCG)의 에너지 대사 촉진 효과와 글루카곤 유사 펩타이드-1(Glucagon-Like Peptide-1, GLP-1)의 식욕억제 및 혈당 감소 효과의 비율을 최적화해 디자인됐다. 페길화(PEGylation) 플랫폼 기술을 접목해 높은 활성과 긴 반감기도 보유했다. 이는 글로벌 임상 2상 진행 중인 자사의 퇴행성 뇌질환 치료제 ‘NLY01’에도 적용된 기술이다. ‘DD01’은 다양한 비만·당뇨 및 지방간질환 전임상 동물 모델에서 부작용 없이 뛰어난 체중감량 효과와 우수한 혈당 조절 효과 및 지방간질환 치료효과를 확인했다. 이번 IND 승인으로 디앤디파마텍은 미국 내 10여개 임상 연구센터에서 2형 당뇨 및 비알콜성 지방간질환을 동반한 과체중·비만 성인을 대상으로 약물의 안전성과 약동학, 약리학적 효과를 확인할 예정이다. 이번 임상시험은 안전성만을 확인하는 통상적인 임상 1상 시험과 달리 장기혈당변화

【 청년일보 】 12월 넷째 주 제약업계 주요 이슈는 제넥신이 미국 바이오 전문 투자사 터렛 캐피털과 PD-L1 단일 융합 면역억제제 ‘GX-P1’에 대한 기술이전 계약을 체결했다는 소식이다. 셀트리온은 자가면역질환 치료제 ‘스텔라라’ 바이오시밀러 ‘CT-P43’의 글로벌 임상 3상을 개시했고, 한미약품 파트너사 스펙트럼은 항암신약 ‘포지오티닙’의 미국 식품의약국(FDA) 허가신청을 내년에 진행할 계획이라고 전했다. 식약처는 메디톡스의 보툴리눔 톡신 제제 ‘이노톡스주’에 대한 잠정 제조·판매·사용을 중지토록 하고 품목허가 취소 등 행정처분 절차에 착수했으며, 씨앤팜은 코로나19 중증환자 치료용 주사제 ‘Poly-COV01’ 개발에 성공했다. 대웅제약의 자가면역치료제 신약후보 물질 ‘DWP212525’는 보건복지부 지원 ‘2020년도 감염병 예방 치료 기술 개발과제’에 선정됐고, 제넥신은 ‘제39회 JP모건 헬스케어 컨퍼런스’에 공식 초청받아 참가한다. 디앤디파마텍은 미국 FDA에 섬유화 질환 치료 후보 물질 ‘TLY012’의 임상 1상 임상 시험 계획서(IND) 신청을 완료했고, 아이디언스의 신약후보물질 ‘IDX-1197’은 미국 FDA의 IND 심사를 통과

【 청년일보 】 22일 제약업계 주요 이슈는 대웅제약의 자가면역치료제 신약후보 물질 ‘DWP212525’가 보건복지부 지원 ‘2020년도 감염병 예방 치료 기술 개발과제’에 선정돼 코로나19 치료제 후보로서 비임상 연구개발비를 지원받게 됐다는 소식이다. 제넥신은 내년 1월 11~14일 온라인으로 진행되는 ‘제39회 JP모건 헬스케어 컨퍼런스’에 공식 초청받아 참가하며, 디앤디파마텍은 미국 식품의약국(FDA)에 섬유화 질환 치료 후보 물질 ‘TLY012’의 임상 1상 임상 시험 계획서 신청을 완료했다. 한국유나이티드제약은 임상 1상 IND 승인을 받은 천연물 유래 항암제 신약 ‘PLK-1’ 저해제의 임상을 준비하는 동시에 미국 기술 이전을 논의 중이며, 일동제약은 편두통 치료제 ‘라스미디탄’과 관련한 가교 3상 임상시험을 종료했다. 대웅제약은 보툴리눔 톡신 제제 ‘나보타’가 비임상 연구를 통해 다양한 온도 조건에서의 ‘역가 안정성’을 입증했다고 전했고, 엔케이맥스는 슈퍼NK 자가 면역세포 치료제 10억개 투여 대상자 3명의 첫 투약 일정을 확정했다. JW중외제약 이상지질혈증 치료제 ‘리바로’의 당뇨병 안전성을 공인한 국가는 기존 21개국에서 31개국으로 늘었으

【 청년일보 】 디앤디파마텍은 미국 식품의약국(FDA)에 섬유화 질환 치료 후보 물질 ‘TLY012’의 임상 1상 임상 시험 계획서(IND) 신청을 완료했다고 22일 밝혔다. FDA의 심사가 완료되면 내년 초 임상 착수가 가능할 것으로 예상된다. 지속형 유전자 재조합 휴먼 트레일(TRAIL, tumor necrosis factor-related apoptosis-inducing ligand) 단백질 의약품인 ‘TLY012’는 만성 췌장염, 전신 경화증에 대해 각각 작년 9월과 올해 5월 미국 FDA 로부터 희귀의약품(Orphan Drug Designation) 지정을 받은 바 있다. 말기 간 섬유화증 및 경화증 전임상 연구결과가 간질환 분야 권위지 헤파톨로지(Hepatology)와 네이처 커뮤니케이션스(Nature Communications)에 게재되어 약물의 새로운 작용기전 및 우수한 효능도 검증됐다. 디앤디파마텍은 이번 임상 1상을 통해 건강한 성인들을 대상으로 약물의 안전성과 내약성 등을 평가할 예정이며 이후 대표적인 섬유화 질환인 만성 췌장염, 전신 경화증, 말기 비알콜성 지방간염(NASH) 및 간 섬유화증을 각각 적응증으로 하는 3개의 임상 2상을
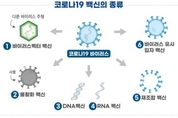
【 청년일보 】 24일 제약업계 주요 이슈는 식품의약품안전처가 SK바이오사이언스가 개발 중인 코로나19 백신 ‘NBP2001’와 동화약품이 개발 중인 치료제 ‘DW2008S’에 대한 임상시험을 각각 승인했다는 소식이다. 한국유나이티드제약은 코로나19 흡입 치료제로 개발 중인 ‘UI030’의 동물효력시험 계약을 체결했고, 이수앱지스는 러시아 제약사 파마신테즈와 ‘ISU305’의 러시아, CIS 지역을 대상으로 한 기술수출 계약을 체결했다. 디앤디파마텍은 미국 FDA에 비만치료 후보 물질 ‘DD01’의 임상 1/2a상 시험 계획서(IND) 신청을 완료했으며, 대웅제약은 미국에서 구매한 신규 홀 에이 하이퍼 보툴리눔 균주를 자사의 시설에 입고하는 등 국내 반입절차를 완료했다. 이밖에 휴온스는 글로벌 헬스케어 시장 공략을 본격화하고 전문성과 생산력 증대를 위해 충북 제천시 바이오밸리에 점안제 전용 ‘휴온스 제2공장’ 건설을 추진한다고 전했으며, 세계보건기구(WHO)는 옥스퍼드대-아스트라제네카의 코로나19 백신 임상시험 결과에 대해 환영 입장을 내놓았다. ◆ 식약처, 국내 개발 코로나19 백신 임상 1상, 치료제 2상 승인 식약처는 SK바이오사이언스가 개발 중인 코로

【 청년일보 】 디앤디파마텍은 미국 식품의약국(FDA)에 비만치료 후보 물질 ‘DD01’의 임상 1/2a상 시험 계획서(IND) 신청을 완료했다고 24일 밝혔다. FDA의 심사가 완료되면 연내 임상 착수가 가능할 것으로 회사 측은 보고 있다. 디앤디파마텍의 국내 연구진들이 개발한 후보물질 ‘DD01’은 글루카곤(Glucagon, GCG)의 에너지 대사를 촉진시키는 효과와 글루카곤 유사 펩타이드-1(Glucagon-Like Peptide-1, GLP-1)의 식욕억제 및 혈당 감소 효과의 비율을 최적화해 체중 감소 효과를 극대화하도록 디자인됐다. 이미 글로벌 임상 2상이 진행 중인 자사의 퇴행성 뇌질환 치료제 ‘NLY01’에 적용된 것과 동일한 페길화(PEGylation) 플랫폼 기술을 사용해 체내에서 매우 긴 반감기를 가질 것으로 예상된다. 디앤디파마텍은 만성적인 치료가 필요한 비만 및 대사성 질환 환자의 복약 편의성 개선에 큰 도움이 될 것으로 전망하고 있다. ‘DD01’은 전임상 단계에서 뛰어난 체중감량 효과와 우수한 혈당 조절 효과를 확인했다. 이번 제출한 IND가 승인되면, 디앤디파마텍은 미국 내 10여개 임상 연구센터에서 2형 당뇨 및 비알콜성 지방간

【 청년일보 】 11월 셋째 주 제약업계 주요 이슈는 미국 국제무역위원회(ITC)가 메디톡스와 대웅제약의 보툴리눔 톡신 균주 영업비밀 침해 소송에 대한 최종판결을 또다시 연기했다는 소식이다. 한미약품은 식약처로부터 고혈압 치료 성분 2가지와 이상지질혈증 치료 성분 2가지를 결합한 4제 복합신약 ‘아모잘탄엑스큐’의 허가를 획득했으며, 삼성바이오에피스는 지난 9월 미국 식품의약국(FDA)에 제출한 ‘SB11’의 바이오 의약품 품목허가 신청서(BLA)에 대한 사전 검토가 완료돼 본격적인 서류 심사가 시작됐다고 전했다. 헬릭스미스는 유전자 치료제 ‘엔젠시스’의 당뇨병성 신경병증(DPN)에 대한 미국 임상 3상(3-2)에서 첫 환자 투약을 실시했으며, 브릿지바이오는 비(非)소세포폐암에 대한 차세대 표적 항암치료제로 개발 중인 ‘BBT-176’의 국내 임상 1/2상 시험을 이르면 연내 시작한다고 발표했다. 이밖에 삼성바이오로직스가 미국 일라이릴리의 신종 코로나바이러스 감염증(코로나19) 항체치료제를 생산하고 있다고 밝혔고, 디앤디파마텍은 미국 FDA로부터 투명 세포 신장암 진단용 조영제 ‘PMI05’의 임상 시험 계획(IND)을 승인 받았다. 아울러 젬백스는 대한치매학

【 청년일보 】 16일 제약업계 주요 이슈는 파멥신이 ‘2020 미국신경종양학회’에서 자사의 항-혈관성장인자수용체-2 항체 ‘올린베시맙’ 임상 2a상 최종 임상연구 보고서를 발표할 예정이라는 소식이다. 디앤디파마텍은 미국 FDA로부터 투명 세포 신장암 진단용 조영제 ‘PMI05’의 임상 시험 계획(IND)을 승인 받았으며, 젬백스는 대한치매학회 추계학술대회에서 알츠하이머병 치료제 ‘GV1001’의 2상 임상시험 결과를 공개했다. 지놈앤컴퍼니는 면역항암 마이크로바이옴 치료제 ‘GEN-001’가 기업주도 1/1b상 임상에 대해 식약처로부터 IND를 승인받았다고 전했고, 종근당 캄토테신계 항암제 신약 ‘캄토벨’의 임상 논문은 SCI급 국제학술지 ‘영국암저널’에 게재됐다. 이밖에 헬릭스미스는 플라스미드 DNA를 1회용 주사기에 넣어 냉장 상태에서 장기간 보관할 수 있는 제형을 개발했으며, 메디포스트는 차세대 줄기세포 치료제 플랫폼 ‘스멉셀’을 활용한 주사형 무릎골관절염 치료제의 국내 1상 임상시험을 완료했다. ◆ 파멥신 “‘2020 SNO’서 재발성 교모세포종 임상 2a상 최종 결과 발표” 파멥신이 오는 19일부터 3일간 미국 텍사스에서 개최되는 ‘2020 미국신경

【 청년일보 】 신약 개발 전문 기업 디앤디파마텍은 미국 식품의약국(FDA)로부터 투명 세포 신장암 (Clear cell Renal Cell Carcinoma, ccRCC)) 진단용 조영제 ‘PMI05’의 임상 시험 계획 (IND)을 승인 받았다고 16일 밝혔다. ‘PMI05’는 SPECT/CT(Single-photon emission computed tomography, 단일 광자 방출 컴퓨터 단층 촬영술; computed tomography, 전산화 단층 촬영술)에 사용되는 조영제다. 디앤디파마텍은 100% 자회사인 미국 프리시전 ‘몰레큘러’를 통해 ‘PMI05’의 글로벌 임상개발을 진행하고 있다. 투명 세포 신장암은 전체 신장암 사례 중 70% 이상을 차지한다. ‘PMI05’는 투명 세포 신장암 환자에게서 과발현되는 단백질인 CAIX(carbonic anhydrase IX)를 타겟으로 하는 저분자물질 SPECT/CT 조영제다. 이번 임상1상 시험은 미국 존스홉킨스 의과대학 PET 영상의학센터에서 진행되며 전이성 투명 세포 신장암 환자를 대상으로 ‘PMI05’의 안전성과 내약성을 평가할 예정이다. ‘PMI05’의 이번 임상 시험 계획 승인으로 디앤디파마텍

【 청년일보 】 11월 첫째 주 제약업계 주요 이슈는 셀트리온이 코로나19 항체 치료제 ‘CT-P59’의 경증환자 대상 임상 1상 시험에서 안전성 및 빠른 바이러스 감소 효과를 확인했다는 소식이다. 에이비엘바이오는 다국적 제약사 하이파이바이오와의 코로나19 치료제 공동개발이 무산됐다고 전했고, 엔케이맥스는 임상 1상에 참여할 알츠하이머 환자 21명 중 3명의 환자 등록을 마치고 슈퍼NK 자가 면역세포치료제 투여 전 PET-CT를 진행 중이라고 밝혔다. 대웅제약은 당뇨병 치료 신약으로 개발 중인 ‘이나보글리플로진’과 메트포르민, DPP-4 억제제의 3제 병용 요법에 대해 식약처로부터 3상 임상 시험을 승인받았으며, 식약처는 뉴젠테라퓨틱스가 코로나19 치료제로 개발 중인 ‘뉴젠나파모스타트정’의 임상 1상 시험계획을 승인했다. GC녹십자는 코로나19 혈장치료제를 현장에서 사용하는 사례가 늘어나자 생산량을 대폭 늘렸으며, 디앤디파마텍은 미국 식품의약국(FDA)으로부터 신경염증 억제 후보물질 ‘NLY01’의 알츠하이머성 치매에 대한 임상 2b상 시험계획(IND)을 승인받았다. 이밖에 셀트리온의 미국 자회사 셀트리온USA는 코로나19 신속진단 항원키트 ‘샘피뉴트’를 미

【 청년일보 】 3일 제약업계 주요 이슈는 GC녹십자가 늘어나는 코로나19 혈장치료제 현장 수요를 감당하기 위해 혈장치료제 3차 생산에 돌입한다는 소식이다. 휴마시스는 스위스에 ‘코로나19 항원 진단키트’를 공급하며, 휴젤은 리프팅실 기업 ‘제이월드’ 인수를 통해 포트폴리오 강화에 나섰다. JW중외제약은 빈혈을 동반한 암 환자를 대상으로 ‘페린젝트’의 치료 효과를 확인했다고 전했고, 디앤디파마텍은 알츠하이머성 치매 임상 2b상에 대한 미국 식품의약국(FDA) 승인을 획득했다. 이수앱지스 파트너사인 미국 카탈리스트는 혈우병 신약 ‘DalcA’ 논문을 학술지에 게재했으며 아스트라제네카가 개발 중인 코로나19 백신의 브라질 접종이 내년 3월 시작될 것이라는 전망이 나왔다. ◆ 늘어나는 코로나19 혈장치료제 현장 수요에…GC녹십자, 3차 생산 돌입 GC녹십자가 신종 코로나바이러스 감염증(코로나19) 혈장치료제를 현장에서 사용하는 사례가 늘어나자, 생산량을 대폭 늘린 것으로 확인. 업계에 따르면, GC녹십자는 의료기관 등 현장에서 코로나19 혈장치료제를 사용하겠다는 수요가 높아지자 3차 생산에 돌입. 이 회사는 코로나19 완치자의 혈장에서 면역원성을 갖춘 항체를 분획