
【 청년일보 】 씨젠의 코로나19 진단키트에 타액 검사법을 적용해 코로나19 진단 시 기존 PCR 검사법인 비인두도말법(코에 면봉을 밀어 넣어 검체를 채취하는 방법)과 유사한 정확도를 보이는 것으로 나타났다. 특히 씨젠의 코로나19 진단키트를 사용해 타액 검사를 실시한 결과 비추출(Extraction free), 다중 진단(변이 포함 코로나19 바이러스, Flu A/B. RSV), 타액 검체 조건에서도 비인두도말 검사 결과와 일치도가 97%에 달했다. 강원대학교 의학과 서인범 교수 연구팀(대한임상의학센터)은 코로나19가 의심돼 병원에 입원한 환자 90명(양성 46명, 음성 44명)을 대상으로 모든 환자의 비인두도말 검체와 타액 검체를 각각 채취해 PCR 검사를 시행했다. 검체는 타액 속 코로나 바이러스의 효과적인 채취를 위해 음식 섭취 등을 제한한 상태로 기상 후 30분간 아무런 활동을 하지 않은 채 채취됐다. PCR 검사에는 씨젠의 코로나19 진단키트 ‘Allplex SARS-CoV-2 Assay’와 코로나19∙독감 등 각종 호흡기 바이러스 동시진단키트인 ‘Allplex SARS-CoV-2/FluA/FluB/RSV Assay’가 사용됐다. 그 결과, 두 종

【 청년일보 】 코로나19 진단키트 대표 기업 씨젠이 금융당국으로부터 중징계를 받게 됐다. 매출 부풀리기 등 회계 처리 기준을 위반한데 따른 조치다. 금융위원회 산하 증권선물위원회는 최근 정례회의를 열고 회계처리 기준을 위반한 코스닥 상장사 씨젠에 대해 과징금, 감사인 지정 3년, 담당 임원 해임 권고 및 직무 정지 6개, 내부통제 개선 권고, 각서 제출요구 등의 조치를 의결했다. 과징금 부과액은 향후 금융위에서 최종적으로 결정할 예정이다. 15일 증선위에 따르면, 씨젠은 지난 2011~2019년 9년간 실제 주문량을 초과하는 과도한 물량의 제품을 대리점으로 임의 반출하고 이를 전부 매출로 인식해 매출액·매출원가·관련 자산 등을 과대 또는 과소 계상했다. 최종 수요처에 납품만 됐을 뿐 실제 판매되지 않은 부분도 수익에 포함한 것이다. 연구·개발(R&D) 비용 회계처리 부분에서도 위법사항이 적발됐다. 지난 2011년부터 7년간 개발비를 과대 계상했다. 이 기간 중 씨젠은 기술적 실현 가능성 등 자산 인식요건을 충족하지 못한 진단 시약 등의 연구개발(R&D) 관련 지출 금액을 개발비로 계상한 것으로 조사됐다. 이밖에 1년 이내 조기 상환청구 가능

【 청년일보 】 신종 코로나바이러스 감염증(코로나19) 변이가 전세계 70여 개 국가로 확산된 가운데, 씨젠이 독자적인 자체 기술력으로 주요 변이 바이러스를 한 번에 구분해낼 수 있는 진단키트 개발을 완료했다. 씨젠은 채취된 검체에서 기존 코로나 바이러스, 영국발 코로나19 바이러스 변이, 남아프리카공화국발 코로나19 바이러스 변이, 다른 변이(일본·브라질발 등) 및 새로운 유형의 신종 변이 등 4가지 바이러스 유형에 대한 적합성을 한 번의 검사로 알아내는 진단키트를 개발해 전 세계 시장에 신속하게 출시 예정이라고 1일 밝혔다. 씨젠이 이번에 개발한 제품은 ‘Allplex SARS-CoV-2 Variants Ⅰ Assay’로 기존 코로나19 바이러스 유전자뿐만 아니라 다수의 코로나19 변이 바이러스 유전자를 한 번의 검사로 검출 및 구분할 수 있는 씨젠만이 개발 가능한 신개념 멀티플렉스(multiplex) 진단제품이다. 바이러스 유전자에서 변이가 발생한 부분을 정확하게 찾아내는 씨젠의 자체 특허기술과 노하우 기술들이 적용돼 있어 변이 바이러스 종을 높은 정확도로 판별해낸다. 뿐만 아니라 씨젠의 이번 제품은 인공지능(AI) 올리고 설계기술을 바탕으로 여러 개의

【 청년일보 】 우리들제약은 코로나19 진단키트 3개 품목에 대한 유럽 CE 인증 획득에 성공했다고 19일 밝혔다. 인증을 획득한 진단키트는 분자진단(PCR) 방식 2종(fineGENE N-CoV RT-PCR, fineGENE COVID-19 RT-PCR)과 항원진단 신속키트 1종(findUS COVID-19 antigen)이다. 우리들제약은 항체진단 신속키트 1종(findUS COVID-19 IgM/IgG)의 CE 인증 절차도 밟고 있다. 회사 측은 지난해 11월 체외진단용 의료기기(현장진단 검사 제품)의 제조 및 판매 분야에서 국제적인 공신력을 확보하기 위해 국제표준 의료기기 품질경영시스템인 ‘ISO 13485’ 인증을 획득한 바 있다. 이번에 CE 인증에 성공한 진단키트 3종은 우리들제약이 지난 2019년 인수한 미국 소재 자회사 엑세스바이오와의 기술협력을 통해 개발된 것이다. 엑세스바이오는 지난해 분자진단 방식과 항원, 항체진단 방식 신속키트의 CE 및 미국 식품의약국(FDA) 긴급사용 승인을 획득했다. 코로나 19 진단키트는 크게 분자진단 방식인 RT-PCR 진단키트와 면역학적 방식의 항체, 항원진단 신속키트로 구분된다. 분자진단은 감염 초기 진단에

【 청년일보 】 분자진단 전문기업 씨젠은 코로나19 진단키트 2종에 타액검사법을 적용하는 것에 대한 유럽 체외진단시약 인증(CE-IVD) 변경 허가를 획득했다고 7일 밝혔다. 해당 제품은 한 번의 검사로 코로나19 타깃 유전자 4종을 진단하는 Allplex SARS-CoV-2 Assay와, 코로나19 및 독감, 감기 등을 한 번의 검사로 동시에 진단할 수 있는 Allplex SARS-CoV-2/FluA/FluB/RSV Assay다. 씨젠은 지난해 말 검사 과정 간소화를 위한 비추출 PCR검사법 유럽 사용 허가(CE-IVD)를 받은 데 이어 이번 타액검사법 적용의 추가 제품 승인으로 콧속 깊숙이 면봉을 넣어 검체를 채취하는 PCR 기본 검사 방법인 비인두도말법과 더불어 타액(침)을 이용한 검사가 모두 가능하게 됐다. 기존의 비인두도말법은 콧속 깊이 위치한 점막을 면봉으로 긁어 검체를 채취하기 때문에 교육을 받은 의료인이 검사를 진행한다고 해도 피검사자가 불편감을 호소하는 경우가 적지 않다. 비인두도말법을 시행하면 콧속에 면봉이 들어가는 과정에서 피검사자가 재채기를 할 수 있는데, 이 과정에서 검사자의 감염 위험도 있다. 이 때문에 검사자는 비인두도말법을 시행할

【 청년일보 】 휴마시스는 셀트리온에 공급하는 코로나19 진단키트 ‘디아트러스트 코로나-19 Ag Rapid Test’ 제품이 셀트리온USA를 통해 미국 진출 초읽기에 들어갔다고 18일 밝혔다. 휴마시스에 따르면, 셀트리온USA는 미국 내 진단키트 및 개인보호장비 전문 도매 유통사인 ’프라임헬스케어 디스트리뷰터스’에 2,400억원 규모의 코로나19 신속진단 항원키트를 공급하는 신규 공급계약을 체결했다. 디아트러스트는 휴마시스와 셀트리온이 공동 개발한 코로나19 신속진단 항원키트 제품으로 휴마시스에서 셀트리온USA에 공급하게 된다. 휴마시스는 셀트리온의 항체를 적용해 바이러스의 특이 표면 항원을 인식할 수 있는 디아트러스트를 개발했으며 해당 진단제품은 코로나19 감염여부를 15분 이내에 진단할 수 있다. 특히 최근 해외에서 진행된 증상일로부터 7일 이내의 환자군을 대상으로 임상 결과 민감도는 전향 샘플에서 100%, 후향 샘플에서 94.3%, 특이도는 100%로 나타남에 따라 제품 성능의 우수성을 입증 받았다. 디아트러스트는 현재 미국 식품의약국(FDA)의 긴급사용승인(EUA)을 위한 절차를 진행하고 있으며, 승인에 맞춰 물량 공급이 이뤄질 예정이다. 휴마시스

【 청년일보 】 씨젠은 식품의약품안전처로부터 코로나19 진단키트 ‘Allplex SARS-CoV-2 Assay’에 대한 정식 승인을 받았다고 7일 밝혔다. 이는 호흡기 바이러스 진단키트 ‘RV Essential Assay’의 정식 승인을 받은 지 일주일 만이다. 이번에 정식 승인을 받은 씨젠의 ‘Allplex SARS-CoV-2 Assay’는 한 번의 검사로 코로나19 바이러스의 4가지 유전자(N gene, RdRp gene, S gene, E gene)를 정확하게 진단해낼 수 있으며 대량 검사가 가능하다. 앞서 지난 2월 식약처로부터 긴급사용 승인을 받은 ‘Allplex 2019-nCoV Assay’ 제품과 비교했을 때 한 종의 유전자 타깃(S gene)을 추가해 검사 정확도를 높였다는 게 회사 측의 설명이다. 코로나19의 경우 주요 증상이 기침, 발열 등 일반적인 감기나 독감과 비슷해 증상만으로는 정확한 원인을 파악하기 어렵다. 이에 씨젠은 코로나19 진단제품에 독자적인 기술력을 투입해 17종의 호흡기 바이러스를 한 번의 검사로 진단하는 ‘RV Essential Assay’와 코로나19 제품을 연계할 수 있도록 했다. 이에 따라 이번에 정식 승인을 받은
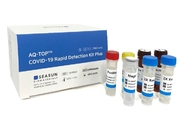
【 청년일보 】 대웅제약은 시선바이오머티리얼스와 코로나19 PCR(Polymerase Chain Reaction, 유전자증폭진단) 진단키트 제품 6종에 대한 글로벌 판매 계약을 맺었다고 26일 밝혔다. 대웅제약이 판매하게 되는 제품들은 신속진단을 위한 ‘에이큐탑시리즈’ 2종과 정밀진단을 위한 3종의 ‘유탑시리즈’, 검체채취 도구인 ‘탑바이러스컬렉션키트’ 등 코로나19 진단의 전 과정을 아우르는 ‘원스톱 진단 플랫폼’이다. 에이큐탑 시리즈(에이큐탑, 에이큐탑플러스)는 루프매개 등온증폭방식의 PCR 진단기술로 30분 만에 코로나19 감염여부를 확인할 수 있는 신속성이 특징이며 응급 선별검사나 공항·항만에서의 출입국자 검사 등에 유용하다. 유탑시리즈 중 ‘유탑’은 미국 식품의약국(FDA)이 진행한 긴급사용승인제품에 대한 성능테스트에서 160여개 제품 중 민감도 3위를 차지했으며 ‘유탑플러스’는 미국 질병통제예방센터와 세계보건기구가 권고한 유전자 4종 모두를 검출할 수 있다. ‘유탑사스플루’는 코로나19뿐아니라 인플루엔자 바이러스 또한 검출이 가능하다는 게 회사 측의 설명이다. 이번 계약으로 판매하는 시선바이오의 6개 제품 전체가 유럽 체외진단용의료기기 인증(CE-

【 청년일보 】 한탑은 관계 회사 지분을 포함해 12.7%를 보유하고 있는 에이스바이오메드가 최근 분자 진단키트와 면역 진단키트의 ‘유럽 체외 진단시약 인증’(CE-IVD)을 동시에 획득했다고 12일 밝혔다. 에이스바이오메드의 코로나19 초고속 분자진단 키트 ‘Palm PCR™ COVID-19 Fast Real-time RT-PCR’은 RT-PCR에 의해 만들어진 PCR 증폭 산물의 양을 실시간으로 측정하는 Real-time RT-PCR 키트다. 주요 시약을 동결건조 형태로 제조해 보관 및 사용이 편리한 이점을 가지고 있는 제품으로 50분 이내에 결과를 확인할 수 있으며 민감도와 특이도가 높은 것이 특징이다. 분자진단 키트와 함께 CE-IVD를 획득한 면역진단 키트 ‘ACEBiomed COVID-19 IgMIgG'도 높은 민감도와 특이도를 가진 우수한 제품임이 증명됐다. 회사 측은 지난 7월 국내 식품의약품안전처로부터 ‘Palm PCR COVID-19 Fast Real-time RT-PCR’의 수출 허가를 획득했고 8월에는 ‘ACEBiomed COVID-19 IgMIgG’의 수출 허가도 획득한 바 있다. 에이스바이오메드 관계자는 “이번 CE-IVD 획득 이외
【 청년일보 】 전 세계적인 신종 코로나바이러스 감염증(이하 코로나19) 사태 확산 이후 ‘폭풍 성장’을 거듭하고 있는 국내 진단키트 업계가 이번엔 러시아 시장을 정조준하고 나섰다. 최근 코로나19 확진자가 급증하고 있는 러시아를 전조기지로 삼아 ‘2차 대유행’이 예고된 주변 국가들에 자사의 진단키트를 보급, 수익시장을 확보하겠다는 전략이다. 12일 제약업계 등에 따르면, 코로나19 누적 확진자 수가 미국·인도·브라질에 이어 세계 4위 규모인 러시아는 하루 확진자 수 또한 2만명에 육박하는 등 연일 역대 최대치를 경신하고 있다. 이에 러시아 정부는 코로나19 환자를 신속하게 확인할 수 있는 항원·항체 진단키트를 적극적으로 도입하고 있다. 러시아 내 코로나19 진단키트 시장은 약 3억 달러(한화 약 3,340억원) 규모로 러시아 생산제품이 40%, 그 외 미국·유럽·한국 등 수입 제품이 60%의 비중을 차지하고 있다. 우선, 휴메딕스는 최근 러시아 정부로부터 코로나19 항원 진단키트 ‘NowCheck COVID-19 Ag Test’의 긴급 사용승인(EUA, Emergency Use Authorization)을 획득했다. 휴메딕스의 항원 진단키트는 국내 진단키트

【 청년일보 】 진매트릭스는 브라질 국가위생감시국(ANVISA)으로부터 코로나19 진단키트 ‘네오플렉스 COVID-19’ 제품 정식 허가를 획득하고 중남미 시장 공략에 나선다고 13일 밝혔다. ‘네오플렉스 COVID-19 Detection Kit’는 지난 5월 미국 식품의약국(FDA)의 긴급사용승인(Emergency Use Authorization, EUA)을 획득했으며 최근 FDA가 주관한 COVID-19 긴급사용승인 진단키트 비교시험 결과에서도 상위권에 등재된 바 있다. 해당 제품은 현재 미국과 유럽·남미·중동·아시아 지역 등에 공급되고 있으며 이번 ANVISA 제품 정식 허가로 중남미 진출을 본격화할 전망이다. 회사 관계자는 “이번 브라질 ANVISA 제품 등록은 간소화된 긴급사용승인 절차가 아닌, 엄격한 브라질 GMP(B-GMP) 및 제품 정규 심사 과정을 정식 통과했다는 측면에서 그 의미가 크다”며 “현지 판매는 브라질 내 대형 제약사와 협력을 통해 진행할 예정”이라고 말했다. 현재 전 세계적으로 코로나19 재유행 조짐이 심화되는 가운데, 브라질은 미국·인도 다음으로 확진자가 많은 국가로, 확진자 수는 약 419만명, 사망자 수는 15만명에 이르고

【 청년일보 】 진매트릭스는 유엔(UN) 산하 아동구호기관 유니세프(UNICEF)와 코로나19 진단키트 ‘네오플렉스 COVID-19’(NeoPlexTM COVID-19 Detection Kit)에 대한 장기공급 계약을 체결했다고 29일 밝혔다. 이번 계약으로 진매트릭스는 회사의 코로나19 진단키트를 최대 2년간 유니세프에 장기 공급한다. ‘네오플렉스 COVID-19’는 지난 5월 미국 식품의약국(FDA)으로부터 긴급사용승인(Emergency Use Authorization, EUA)을 획득했으며 최근 FDA가 주관한 COVID-19 긴급사용승인 진단키트 비교시험 결과에서도 상위권에 등재된 바 있다. 회사 관계자는 “네오플렉스 제품의 검증된 기술력과 우수한 성능 평가결과를 근거로 올 4월부터 유니세프 글로벌 공공 조달을 위해 외교부와 조달청이 주관한 ‘해외 공공 조달 입찰 지원사업’에 참여했다”며 “해외 공공 조달 전문연구 기관인 한국과학기술원(KAIST) 글로벌공공조달연구센터와 협업으로 최종 공급자로 선정될 수 있었다”고 설명했다. 현재 ‘네오플렉스 COVID-19’ 진단키트는 미국·유럽·남미·중동·아시아 등에 공급되고 있으며 이번 글로벌 공공조달 계약체결로